Regeneracija se definiše kao proces u ljudskom telu gde se gubitak specijalizovanog tkiva nadoknađuje rastom (proliferacijom) neoštećenih specijalizovanih ćelija. Termin regenerativna medicina definiše tehnološki postupak koji zamenjuje ili regeneriše ljudske ćelije, tkiva ili organe sa ciljem uspostavljanja ponovne normalne funkcije organa ili organizma.
Strategija regenerativne medicine se bazira na pokretanju mehanizama koji su slični prirodnima ali nedostaju kod određenih grupa tkiva. Ta strategija podrazumeva da se na mesto povrede ili oštećenja dovedu populacije ćelije koje u normalnim, biološkim okolnostima ne bi mogle biti dopremljene . Da bi se postupak regeneracije desio, nije dovoljno samo “ baciti“ ćelije u oštećenu zonu.
Za postupak regeneracije je pored ćelija potrebno da prisustvuju još tri faktora: prisustvo bioloških molekula (poput faktora rasta, citokina, hormona, anti-tela i drugih stimulusa) koji su neophodni za aktiviranje procesa diferencijacije i proliferacije ka ciljanim tkivima koje je potrebno regenerisati ili za modulaciju imunog odgovora , fizički ili mehanički uslovi koji podrazumevaju omogućavanje kontakt oštećenih tkiva, npr. pokidanih krajeva tetive (operativno ili imobilizacijom nekom od ortoza ili gipsa) i prisustvo nosača za ćelije, trodimenzionalne strukture ili materijala sa kojim se na primer popunjava defekt hrskavice ili kosti a u kome se nalaze ćelije koje treba svojim rastom da formiraju tkivo koje popunjava nastali defekt.
U ortopedskoj hirurgiji se regenerativne terapije apliciraju putem inekcija u oboleli zglob ili tkivo ili operativno jednom od modernih hirurških tehnika.
Kada govoriom o inekcijama koje se daju u zglob sa ciljem lečenja osteoartritisa, one se dele u više grupa prema svom hemijskom ili biološkom sastavu. Spisak inekcionih terapija dat je na slici ispod.
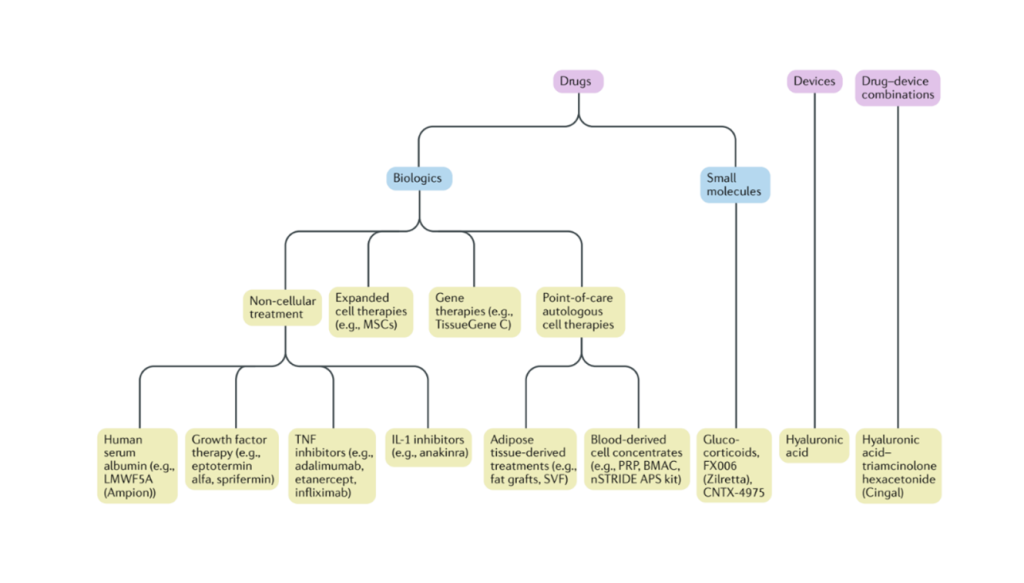
Najčešće prepeoručene inekcije u lečenju osteoartritisa zglobova, koje koristimo u našoj bolnici i registrovane su u našoj zemlji su su PRP, BMAC i preparati hijaluronske kiseline kao i njihove kombinacije u skladu sa indikacijama.
LEČENJE PLAZMOM OBOGAĆENOM TROMBOCITIMA ( PRP)
U odnosu na stanje vašeg zgloba, mišića, tetive itd., vaš hirurg će vam preporučiti najbolju formulu ove terpije. U našoj bolnici na raspolaganju vam stoje PRP formulacije svih registrovanih proizvođača na tržištu koji će se davati prema adekvatnim indikacijama.
Nakon vađenja krvi iz vene, potrebno je sačekati 20-30 minuta da se pripremi inekcija. Potom se ona aplicira u oboleo ili povređen deo vašeg tela. PRP može da se aplicira kao jedna doza (monodoza u kojoj se nalazi viša koncentracija trombocita) ili u više doza, u odnosu na preporuku vašeg lekara.
Nakon davanja inekcije, bićete upućeni na fizikalnu terapiju u skladu sa jednim od protokola koji se preporučuju za određenu vrstu regenerativne terapije.
U daljem tekstu, daćemo vam neke informacije u vezi sa PRP terapijom.
Danas najčešće korišćena ćelijska terapija u regenerativnoj medicini je plazma obogaćena trombocitima ili PRP ( Platelet Rich Plasma eng.). Postoji nekoliko definicija plazme obogaćene trombocitima. PRP se definiše kao koncentrat trombocita nekoliko puta veći od normalne vrednosti a najmanje 1.000.000 /µL rastvorenih u plazmi. Druga definicija PRP opisuje kao suspenziju plazme koja sadrži sve komponente krvi u odnosima različitim od fizioloških“. Dakle PRP bi mogli definisati kao koncentrat trombocita u limitiranom volumenu plazme koji se koristi u različitim procedurama hirurške regeneracije tkiva, gde faktori rasta koji potiču iz trombocita pospešuju rast tkiva i proces izlečenja. Kao što se vidi iz ove definicije, akcenat se stavlja na faktore rasta sa kojima su trombociti bogati.

Kao što je poznato, trombociti su fragmenti megakariocita, koji nastaju u koštanoj srži “otcepljenjem” od mekakariocitnih pseudopoda. Sa obzirom na način nastanka, trombociti su anuklearni, diskoidnog su oblika i heterogeni po svojoj veličini koja je u proseku oko 2 µm, što ih čini najmanjim fragmentima krvi ( npr. leukociti su velečine oko 20 µm). Kada se nađu u cirkulaciji, putuju negde oko 7-10 dana vršeći svoju biološku funkciju a potom bivaju uklonjeni i zamenjeni sa novim trombocitima.
Normalna vrednost trombocita je od 100.000-400,000 u µL krvi. Primarna funkcija trombocita je u procesima zgrušavanja krvi (hemostaze) i tromboze ali je njihova uloga danas opisana i u mnogim drugim fiziološkim i patološkim procesima poput upale (inflamacije), zarastanja rana, metastaza tumora i stvaranja novih krvnih sudova (angiogeneze). Važnu ulogu u mnogim biološkim mehanizmima trombocitima daje sadržaj njihovih granula. Postoje tri vrste trombocitnih granula: “dense” granule, “alfa” granule i lizozomne granule, i u svakom trombocitu se nalazi od 50-80 granula koji su potpuno heterogene po svom sastavu .
Do danas je poznato preko 300 proteina koji se nalaze u trombocitnim granulama sa velikim brojem bioloških funkcija. Kada se uzmu u obzir i membranski proteini samih trombocita, opisano ih je više od 1048 u suvom ostatku trombocita. Klasičan, manuelni način dobijanja PRP koristi protokol od dva koraka centrifugiranja venske krvi. Prvo se određena količina venske krvi ( uobičajeno je od 60-100 ml), kojoj se dodaje jedan od komercijalnih antikoagulanata, centrifugira na manjim brzinama (tkzv. softspin). Nakon određenog vremena koji se meri minutima ( u zavisnosti od vrste centrifuge) stub krvi se separiše na tri sloja: Eritrociti (RBCs- Red Blood Cells), tkzv. ‘buffy coat’ (BC) ili srednji sloj i sloj čiste plazme siromašne trombocitima (PPP-platelet-poor plasma). BC čini samo 1% stuba ali je veoma tipičan jer se karakteriše beličastom bojom koja je u kontrastu sa izraženom crvenom bojom eritrocita koji su na dnu stuba i žutom bojom plazme koja je na vrhu stuba i sadrži uglavnom trombocite i leukocite.
Da bi se dobio P-PRP, PPP i površni sloj BC se transferišu u drugu epruvetu koja se ponovo centrifugira, ovoga puta na većim obrtajima (hardspin) nekoliko minuta. Na dnu epruvete će ostati jedna frakcija BC- čisti trombociti i deo plazme sa fibrinom, dok će na vrhu preostati plazma sa leukocitima. Da bi se dobio L-PRP, PPP, ceo BC uz koji se obično aspirira i mali deo RBC se transferiše u drugu epruvetu i ponovo nekoliko minuta centrifugira na „hardspin“ opciji. Kada se ukloni PPP, preostaje L-PRP koji u sebi sadrži trombocite, leukocite i minimalni broj deo eritrocita zajedno sa fibrinom i plazmom. Izgled tipičnog preparata PRP dat je na donjoj slici.
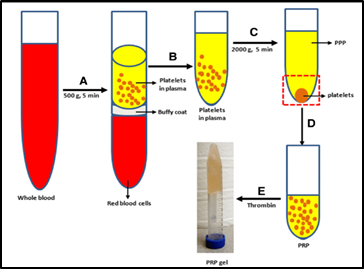
PRP je podeljen na 4 vrste, u odnosu na sadržaj leukocita i fibrina: 1) čista trombocitima obogaćena plazma ( P-PRP– pure PRP); 2) leukocitima i trombocitima obogaćena plazma (L-PRP- Leukocyte-PRP); 3) čist trombocitima obogaćen fibrin ( P-PRF– pure platelet rich fibrin) i 4) leukocitima i trombocitima obogaćen fibrin (L-PRF– Leukocyte and Platelet rich fibrin). Direktna injekcija PRP u zglob ili meka tkiva ima analgetski, antiinflamatorni i regenerativni efekat. Od preko 300 bioaktivnih proteina u granulama trombocita, faktori rasta ( GF- Grow Factors) igraju najvažniju ulogu za terapeutsko dejstvo.
Oni koji se nalaze u izraženijoj koncentraciji su transformišući faktor rasta beta (Transforming Growth Factor – TGF-β), faktor rasta poreklom od trombocita ( Platelets Derived Growth Factor– PDGF), vaskularni endotelijalni faktor rasta (Vascular Endothelial Growth Factor –VEGF) i epidermalni faktor rasta (Epidermal Growth Factor –EGF) , faktor rasta poput insulina (Insulin like Growth Factors-IGF), trombocitni faktor 4 (Platelet Factor-4 – PF-4) itd.
Kada se trombociti nađu u upalnom (inflamatornom) ili ozlednom okruženju oslobađaju svoje eksosome u kojima se nalaze aktivne supstance. Eksosomi su male vezikule veličine 50–150 nm u dijametru i sadrže specifične protein lipide i nukleinske kiseline (DNA, mRNAs, miRNAs, i druge nekodirajuće male fragmente), sekretuju se od gotovo svih metabolički aktivnih ćelija i opisani su u plazmi obogaćenoj trombocitima. PRP je danas u ortopediji najčešće korišćen regenerativni preparat, koji se aplicira kako putem inekcije u zglob ili meko tkivo tako i hirurški, a često može da služi i kao „scaffold“ ili nosač za druge ćelije.
LEČENJE MATIČNIM ĆELIJAMA ( BMAC)
BMAC se koristi u terapiji osteoartritisa kolena i kuka kao i za lečenje bolesti hrskavica, kao ćelijski „rezervoar“ u lečenju nesraslih preloma i u lečenju povreda mišića i tetiva.
Ukoliko vam je vaš lekar preporučio inekciju BMAC u koleno, kuk ili drugi zglob, intervencija uzimanja ćelija iz kosti se radi u blagoj anesteziji ( analgosedaciji) i traje oko 10 minuta.
Nakon toga je neophodno oko 30 minuta da se uz pomoć posebne opreme dobije ćelijski koncentrat koji se potom ubrizgava u zglob. Nakon same intervecnije ćete biti zamoljeni da ne upravljate motornim vozilom oko dva sata, zbog delovanja anestezije.
Dakle, za samu intervenciju je neophodno oko sat vremena. Nakon intervencije ćete moći da hodate sa punim osloncem, a preporuka je da se uzdržite od čučanja, klečanja i nošenja terete oko 7 dana. Na mestu uzimanja koštane srži ćete imati jedan minimalni šav, koji se uklanja za 5 dana.
Takođe, biće vam preporučeno da otpočnete sa specifičnom fizikalnom terapijom i vežbama mišića.
U kliničkoj praksi u našoj zemlji se kao najčešći izvor matičnih ćelija koristi koštana srž i masno tkivo te će se opisati ukratko način njihovog dobijanja i ponašanja u ciljanom tkivu.
Koštana srž se aspirira putem trepanacije karlične kosti ili potkolenice kada se pod negativnim pritiskom aspirira od 60-150 ml. koštane srži.
Potom se aspirat koncentriše putem centrifugiranja da bi se dobio koncentrat ovih ćelija koji se naziva aspirat koncentrata koštane srži ili BMAC (Bone Marrow Aspirate Concentrate, eng.) koji je spreman za kliničku upotrebu.
U aspiratu kostne srži se u visokoj koncentraciji nalaze ćelije krvi kao i njihove matične ćelije kao i tkzv. Mezenhimalne matične ćelije iz kojih nastaju hrskavice, kost, mišići i tetive prilikom rasta i razvoja.

Sve ove ćelije se mogu naći u različitim fazama diferencijacije i u koncentratu aspirata kostne srži, ovaj procenat se uvećava nekoliko puta. Za terapijsku funkciju BMAC je značajno da hematopoetska progenitorna ćelija može da se pretvori („to morph“ eng.) u mezenhimalnu matičnu ćeliju, da diferentuje ka hondrocitu i čak je mnogo osteoinduktivnija nego npr. mezenhimalna matična ćelija poreklom iz masnog tkiva.
U BMAC se pored ćelija nalaze i njihovi ekskretorni produkti poput faktora rasta poreklom iz trombocita (PDGF- platelet-derived growth factor), transformišući faktor rasta ( TGF-b-transforming growth factor-beta), koštani morfogenetski proteini (BMP – bone morphogenetic protein -2 i BMP-7), factor rasta poreklom iz vaskualrnog endotela (vascular endothelial growth fact-VEGF) , factor rasta fibroblasta ( fibroblast growth factor-FGF) kao i Interleukin-1 receptor antagonist (IlRa).
Danas se smatra da gotovo ni jedna od ovih MsC, kada se nađe u inflamatornom okruženju se neće diferentovati ka hondroblastu ili osteoblastu, sintetizovati matriks i formirati subhondralnu kost. Ove ćelije, ispuštajući u okruženje proteinske produkte, pokreću važne procese imunomodulacije koji smanjuju inflamaciju, deluju na ćelije koje su u „uspavanom“, kataboličkom modu da (putem signala i menjajući fenotipske karakteristike) počnu da deluju anabolički.
U tom novoformiranom okruženju u kome su „domaće“ stem ćelije bile „uspavane“, dolazi do njihove aktivacije ka proliferaciji i diferencijaciji ka ciljanom tkivu koje treba regenerisati. Ubrizgane u upalno okruženje, ove ćelije „orkestriraju“ veliki broj biohemijskih procesa koji dovode do promena i jasno se iskazuju kroz kliničke manifestacije.
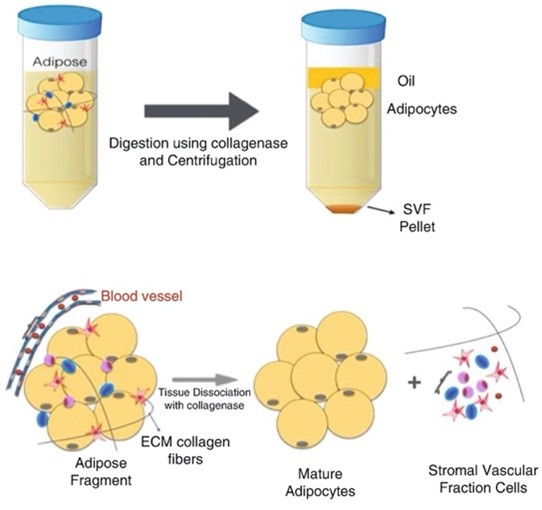
Drugi obilan izvor matičnih ćelija je masno tkivo. Terapijski supstrat dobijen ovim načinom naziva se stromalna vaskularna frakcija ( Stromal Vascular Fraction– SVF). Ove ćelije se dobijaju nakon aspiracije masnog tkiva iz predela bedara ili trbuha, kada se 60-150 ml. lipoaspirata centrifugira u nekoliko navrata, ili se u pojedinim tehnološkim rešenjima podvrgava enzimskoj digestiji. Proces dobijanja ćelija iz masnog tkiva dat je na slici br. 4.
Nakon aspiracije masnog tkiva, centrifugiranjem se dobija tkzv. „SVF pelet“ iz koga se izdvajaja ćelijski koncentrat koji se deli u tri grupe: zrele ćelije, među kojima dominiraju adipociti ali i fibroblasti, glatke mišićne ćelije, endotelijalne ćelije i krvne ćelije; progenitorske ćelije u koje spadaju endotelijalne progenitorske ćelije, preadipociti, vaskularni progenitori i hematopoetski progenitori i na kraju grupa stem ćelija sa predominacijom mezenhimalnih stromalnih ćelija, hematopoetskih ćelija i pericita. Ovaj izvor je bogatiji MsC ćelijama u odnosu na BMAC ali ove ćelije imaju drugačiji osteogeni i hondrogeni potencijal. SVF se koristi u lečenju osteoartritisa velikih zglobova i u više indikacija sa akutnim ili hroničnim povredama mekih tkiva.
LEČENJE HIJALURONSKOM KISELINOM
U našoj bolnici, na raspolaganju je više vrsta preparata hijaluronske kiseline koji će vam biti preporučeni i propisani u odnosu na vrstu i stadijum oboljenja koje imate. Preparati koje vam preporučujemo se sastoje od hijaluronske kiseline različitih molekulskih koncentracija kao i u kombinaciji sa PRP ili kortikosteroidima.
Inekcija se ubrizgava u koleno, kuk ( u blagoj anesteziji pod kontrolom ultrazvuka) ili neki drugi zglob ( rame, skočni zglob itd.) a nakon intervencije ćete biti upućeni na adekvatnu fizikalnu terapiju. Nakon intervencija ne postoje veća ograničenja u smislu radnih i životnih aktivnosti osim preporuke da se izbegne čučanje, klečanje i nošenje tereta u narednih 5-7 dana.
U daljem tekstu ćemo vas uputiti u strukturu kao i u mehanizam dejstva hijaluronske kiseline u lečenju ortopedskih stanja.
Hijaluronska kiselina-HA (C33H54N2O23) je prirodni ugljeni hidrat koji se nomalno nalazi u ljudskom telu. HA je amorfna, providna supstanca u klasi glikozamonoglikana ili kiselih mukopolisaharida sa glavnom funkcijom popunjavanja ekstracelularnog prostora između kolagenih fibrila ali i značajnim transportnim i signalnim funkcijama.
U biološkom okruženju, HA ima ulogu privlačenja vode, lubriciranja intracelularnih struktura i davanja volumena tkivu, na način da formira želatinozni matriks unutar koga elastin i fibrile kolagena mogu biti koagulisane i polagane po neophodnom redu. Njena uloga je takođe da obezbeđuje viskoelastična svojstva sinovijalnoj tečnosti. Pored sinovijalne tečnosti i hijaline hrskavice, HA se nalazi i u drugim tkivnim tečnostima poput očne „vodice“, ali i u koži, umbilikalnom tkivu i mnogim drugim tkivima.
HA se u organizmu prirodno sintetiše putem jedinstvenog, strogo kontrolisanog i kontinuiranog procesa unutar fibroblasta, keratinocita, sinoviocita i hondrocita. Prosečan ljudski organizam od 70 kg sadrži oko 15 grama HA a svakog dana se razloži i ponovo sintetiše oko 5 grama procesima degradacije i enzimske sinteze .

Što se tiče preparata HA koji se koriti u medicinske svrhe, izvori sinteze HA mogu biti životinjskog porekla (spominje se nekoliko izvora kod prerade životinja poput petlove kreste) porekla umbilikalnog tkiva ili sintetski dobijen in vitro bio-fermentacijom od strane genetski modifikovanih bakterija.
Danas, pored primene u lečenju zglobnih oboljenja, HA se u medicini koristi i kao acelularni nosač ili „skafold“ u regenerativnoj medicini ali i kao „filer“ u plastičnoj i rekonstruktivnoj hirurgiji. Pored toga, danas se razne forme HA mogu naći u kremama, gelovima, pastama, hidrogelovima, filmovima itd. kao jedno od najpopularnijih sadržaja preparata za „podmlađivanje“ i „ulepšavanje“.
Najčešće se u kliničkoj primeni ovi preparati dele prema molekularnoj težini pa tako postoje inekcije HA niske molekularne težine, intermedijalne i visoke molekuarne težine. Preparati niske molekularne težine (0.5-1.5 miliona Da) postižu maksimalnu koncentraciju kada se ubrizgaju u zglob sa jasnim anti-inflamatornim efektom ali i sa efektom smanjenja viskoelastičnosti prirodne HA u sinovijalnoj tečnosti. Preparati HA visoke molekularne težine (6-7 miliona Da) sa druge strane povećavaju retenciju fluida i viskoelastičnosti sa još snažnijim anti-inflamatornim efektom.
Tokom OA procesa , kako se menjaju sve strukture zgloba tako dolazi i do promene viskoziteta i smanjivanja molekularne težine HA što doprinosi progresiji bolesti i njenom načinu delovanja u inflamatornom okruženju. Kada se HA ubrizga u zglob, njeno je delovanje u nekoliko pravaca: šok absorpcija, lubrikacija zgloba, anti-inflamatorno delovanje, hondroprotekcija, sinteza proteoglikana i anaboličke promene matriksa. Pored dejstva samim fizičkim prisustvom, HA aktivno učestvuje u više bioloških procesa mehanizmima: hondroprotektivnim dejstvom, antiinflamatornim dejstvom, sintezom proteoglikana i glikozaminoglikana (GAG) i analgetskim efektoom. Intra-artikularna inekcija HA ne samo da povećava sintezu proteoglikana i glikozaminoglikana, u hondrocitima i njihovo izlučivanje u matriks već i smanjuje njihovu degradaciju . Anti-inflamatorni efekat, intraartikularna inekcija HA ispoljava preko supresije ekspresije Il-1 β putem koga se smanjuje sintezu metaloproteinaza (192) kao i putem supresije sinteze pro-inflamatornih citokina IL-8, IL-6, PGE2 i TNFα (185,193). Analgetski efekat HA se postiže najverovatnije delovanjem molekula HA na jonske kanale (stretch activated ion channels) koji su neophodni za aktivnost receptora bola u obolelim tkivima i smanjenje nociocepcije.
Doc. Dr Sci. Med. Oliver Dulic




